PRALUENT 150 mg, solution injectable en stylo prérempli, boîte de 2 stylos préremplis de 1 mL
Dernière révision : 19/12/2024
Taux de TVA : 2.1%
Prix de vente : 430,37 €
Taux remboursement SS : 65%
Base remboursement SS : 430,37 €
Laboratoire exploitant : SANOFI WINTHROP INDUSTRIE
Hypercholestérolémie primaire et dyslipidémie mixte
Praluent est indiqué chez l'adulte présentant une hypercholestérolémie primaire (hétérozygote familiale et non familiale) ou une dyslipidémie mixte, et chez les enfants à partir de 8 ans présentant une hypercholestérolémie familiale hétérozygote (HFHe) en complément d'un régime alimentaire :
- en association avec une statine seule ou une statine avec d'autres thérapies hypolipémiantes chez les patients ne pouvant atteindre leur objectif de LDL-C, sous statine à dose maximale tolérée ou,
- seul ou en association avec d'autres thérapies hypolipémiantes chez les patients intolérants aux statines, ou chez qui les statines sont contre-indiquées.
Maladie cardiovasculaire athéroscléreuse établie
Praluent est indiqué chez les adultes avec une maladie cardiovasculaire athéroscléreuse établie pour réduire le risque cardiovasculaire en diminuant les taux de LDL-C, en complément de la correction des autres facteurs de risque :
- en association avec une statine à la dose maximale tolérée avec ou sans autres thérapies hypolipémiantes ou,
- seul ou en association avec d'autres thérapies hypolipémiantes chez les patients intolérants aux statines, ou chez qui les statines sont contre-indiquées.
Pour les résultats des études concernant les effets sur le LDL-C, les événements cardiovasculaires et les populations étudiées, voir rubrique Propriétés pharmacodynamiques.
Hypersensibilité à la substance active ou à l'un des excipients mentionnés à la rubrique Liste des excipients.
Traçabilité
Afin d'améliorer la traçabilité des médicaments biologiques, le nom et le numéro de lot du produit administré doivent être clairement enregistrés.
Réactions allergiques
Des
réactions allergiques générales, dont le prurit, ainsi que des
réactions allergiques rares et parfois graves, telles
qu'hypersensibilité, eczéma nummulaire, urticaire et vascularite
d'hypersensibilité ont été rapportées dans les études cliniques. Des
cas d'angiœdème ont été rapportés depuis la commercialisation (voir
rubrique Effets indésirables). Si des signes ou symptômes de
réaction allergique grave se manifestent, le traitement par alirocumab
doit être arrêté et il convient d'instaurer un traitement symptomatique
approprié (voir rubrique Contre-indications).
Insuffisance rénale
Peu de patients avec une insuffisance rénale sévère (définies par un DFG < 30 mL/min/1,73 m2) ont été inclus dans les études cliniques (voir rubrique Propriétés pharmacocinétiques). L'alirocumab doit être utilisé avec prudence chez les patients avec une insuffisance rénale sévère.
Insuffisance hépatique
L'alirocumab n'a pas été étudié chez les patients avec une insuffisance hépatique sévère (Classe C de Child- Pugh) (voir rubrique Propriétés pharmacocinétiques). L'alirocumab doit être utilisé avec prudence chez les patients avec une insuffisance hépatique sévère.
Résumé du profil de sécurité
Les effets indésirables les plus fréquents, aux doses recommandées, sont des réactions locales au site d'injection (6,1 %), des symptômes des voies aériennes supérieures (2,0 %) et un prurit (1,1 %). Les effets indésirables les plus fréquents conduisant à un arrêt du traitement chez les patients traités par alirocumab étaient des réactions locales au site d'injection.
Le profil de sécurité dans l'étude ODYSSEY OUTCOMES était conforme au profil global de sécurité décrit dans les essais contrôlés de phase 3.
Aucune différence n'a été observée dans le profil de sécurité entre les deux doses (75 mg et 150 mg) utilisées durant le programme de phase 3.
Tableau résumé des effets indésirables
Les effets indésirables suivants ont été rapportés chez les patients traités par l'alirocumab dans les études contrôlées poolées et/ou l'utilisation après commercialisation (voir tableau 1).
Les fréquences de tous les effets indésirables identifiés au cours des essais cliniques ont été calculées en fonction de leur incidence dans les essais cliniques de phase 3 poolés. Les effets indésirables sont présentés selon le système de classification par organe. Les catégories de fréquence sont définies de la manière suivante : très fréquent (≥ 1/10) ; fréquent (≥ 1/100, < 1/10) ; peu fréquent (≥ 1/1 000, < 1/100) ; rare (≥ 1/10 000, < 1/1 000) ; très rare (< 1/10 000) et fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
La fréquence des effets indésirables rapportés au cours de l'utilisation après commercialisation ne peut pas être déterminée car ils proviennent de déclarations spontanées. En conséquence, la fréquence de ces effets indésirables est qualifiée d'« indéterminée ».
Tableau 1. Effets indésirables
| Classe de système d'organes | Fréquent | Rare | Fréquence indéterminée |
| Affections du système immunitaire | Hypersensibilité, vascularite d'hypersensibilité | ||
| Affections respiratoires, thoraciques et médiastinales | Symptômes des voies aériennes supérieures* | ||
| Affections de la peau et du tissu sous-cutané | Prurit | Urticaire, eczéma nummulaire | Angiœdème |
| Troubles généraux et anomalies au site d'administration | Réactions au site d'injection** | Syndrome pseudo- grippal |
* incluant principalement douleurs oropharyngées, rhinorrhées, éternuements.
** incluant érythème/rougeur, démangeaisons, gonflement, douleur/sensibilité.
** incluant érythème/rougeur, démangeaisons, gonflement, douleur/sensibilité.
Description de certains effets indésirables
Réactions locales au site d'injection
Des réactions locales au site d'injection, notamment érythème/rougeur,
démangeaisons, gonflement, douleur/sensibilité ont été rapportées chez
6,1 % des patients traités par l'alirocumab versus 4,1 % dans le groupe
contrôle (recevant des injections de placebo). La plupart des réactions
au site d'injection étaient transitoires et de faible intensité. Les
taux d'arrêt de traitement dû à des réactions locales au site
d'injection étaient comparables entre les deux groupes (0,2 % dans le
groupe alirocumab versus 0,3 % dans le groupe contrôle). Dans l'étude
de morbimortalité cardiovasculaire (ODYSSEY OUTCOMES), les réactions au
site d'injection sont aussi survenues plus fréquemment chez les
patients traités par alirocumab que chez les patients traités par
placebo (3,8 % sous alirocumab versus 2,1 % sous placebo).
Réactions allergiques générales
Des réactions allergiques générales ont été rapportées plus fréquemment
dans le groupe alirocumab (8,1 % des patients) que dans le groupe
contrôle (7,0 % des patients) principalement en raison d'une différence
dans l'incidence du prurit. Les cas de prurit observés étaient
généralement légers et transitoires. De plus, des réactions allergiques
rares et parfois graves, telles que l'hypersensibilité, l'eczéma
nummulaire, l'urticaire et la vascularite d'hypersensibilité ont été
rapportées dans les études cliniques contrôlées (voir rubrique Mises en garde spéciales et précautions d'emploi).
Dans l'étude de morbimortalité cardiovasculaire (ODYSSEY OUTCOMES), les
réactions allergiques générales étaient similaires chez les patients
traités par alirocumab et chez les patients traités par placebo (7,9 %
sous alirocumab, 7,8 % sous placebo). Aucune différence n'a été
observée dans l'incidence du prurit.
Populations particulières
Personnes âgées
Bien qu'aucun problème de sécurité n'ait été observé chez les patients
âgés de plus de 75 ans, les données sont limitées dans ce groupe d'âge.
Dans les études contrôlées de phase 3 portant sur
l'hypercholestérolémie primaire et la dyslipidémie mixte, 1 158
patients (34,7 %) traités par alirocumab étaient âgés de ≥ 65 ans, et
241 patients (7,2 %) traités par alirocumab étaient âgés de ≥ 75 ans.
Dans l'étude contrôlée de morbimortalité cardiovasculaire, 2 505
patients (26,5 %) traités par alirocumab étaient âgés de ≥ 65 ans, et
493 patients (5,2 %) traités par alirocumab étaient âgés de ≥ 75 ans.
Aucune différence significative quant à la sécurité ou l'efficacité n'a
été observée avec l'augmentation de l'âge.
Population pédiatrique
La sécurité et l'efficacité de Praluent ont été établies chez les
enfants et les adolescents atteints d'hypercholestérolémie familiale
hétérozygote (HFHe). Une étude clinique visant à évaluer les effets de
Praluent a été menée chez 153 patients âgés de 8 à 17 ans atteints de
HFHe. Aucun nouveau résultat en matière de sécurité n'a été identifié
et les données de sécurité dans cette population étaient cohérentes
avec le profil de sécurité connu du produit chez les adultes atteints
de HFHe.
L'expérience relative à l'alirocumab chez les patients pédiatriques atteints d'hypercholestérolémie familiale homozygote (HFHo) est limitée à 18 patients âgés de 8 à 17 ans. Aucun nouveau constat de sécurité n'a été observé par rapport au profil de sécurité connu chez l'adulte.
Étude du schéma posologique avec une fréquence d'administration d'une fois toutes les 4 semaines
Le profil de tolérance chez les patients traités avec 300 mg toutes les 4 semaines (mensuellement) était similaire au profil de tolérance décrit dans le programme d'études cliniques utilisant un schéma posologique avec une fréquence d'administration d'une fois toutes les 2 semaines, excepté pour un taux plus élevé de réactions locales au site d'injection. Les réactions locales au site d'injection ont été rapportées chez 16,6 % des patients du groupe recevant alirocumab 300 mg toutes les 4 semaines et 7,9 % dans le groupe contrôle. Les patients du groupe recevant alirocumab 300 mg toutes les 4 semaines recevaient alternativement des injections de placebo pour ne pas lever l'insu en regard de la fréquence des injections. En dehors des réactions locales au site d'injection (ISRs) survenant après injection de placebo, la fréquance des ISRs était de 11.8 %. Le taux de sortie d'étude suite aux réactions au site d'injection a été de 0,7 % dans le groupe 300 mg toutes les 4 semaines versus 0 % dans le groupe contrôle.
Valeurs de LDL-C < 0,25 g/L (0,65 mmol/L)
Dans l'ensemble des études cliniques les traitements hypolipémiants de fond n'ont pas pu être ajustés du fait du design des études. Le pourcentage de patients ayant atteint des valeurs de LDL-C < 25 mg/dl(< 0,65 mmol/l) dépendait à la fois du taux initial de LDL-C et de la dose d'alirocumab.
Dans un pool d'études contrôlées avec une la dose initiale de 75 mg toutes les 2 semaines (Q2S) et augmentée à 150 mg Q2S si le taux de LDL-C du patient n'était pas < 70 mg/dl ou < 100 mg/dl (1,81 mmol/l ou 2,59 mmol/l) : 29,3 % des patients dont le taux initial de LDL-C était < 100 mg/dl et 5,0 % des patients dont le taux initial de LDL-C était ≥ 100 mg/dl, traités par alirocumab ont présenté deux valeurs consécutives de LDL-C < 25 mg/dl (< 0,65 mmol/l). Dans l'étude ODYSSEY OUTCOMES la dose initiale d'alirocumab était de 75 mg Q2S et était augmentée à 150 mg Q2S si le taux de LDL-C du patient n'était pas < 50 mg/dl (1,29 mmol/l) : 54,8 % des patients dont le taux initial de LDL-C était < 100 mg/dl et 24,2 % des patients dont le taux initial de LDL-C était ≥ 100 mg/dl, traités par alirocumab ont présenté deux valeurs consécutives de LDL-C < 25 mg/dl (< 0,65 mmol/l).
Bien qu'aucune conséquence défavorable de très faibles taux de LDL-C n'ait été identifiée dans le cadre des essais avec l'alirocumab, les effets à long terme de taux très bas de LDL-C prolongés dans le temps sont inconnus.
Immunogénicité / Anticorps anti-médicament (Anti-drug-antibodies (ADA))
Dans l'étude ODYSSEY OUTCOMES, 5,5 % des patients traités par alirocumab 75 mg et/ou 150 mg toutes les 2 semaines (Q2S) ont eu des anticorps anti-médicament (ADA) detectés après le début du traitement versus 1,6 % des patients traités par placebo, la plupart étaient transitoires. Des réponses ADA persistantes ont été observées chez 0,7 % des patients traités par alirocumab et chez 0,4 % des patients traités par placebo. Des anticorps neutralisants (AcN) ont été observées chez 0,5 % des patients traités par alirocumab et chez < 0,1 % des patients traités par placebo.
Les
réponses ADA, y compris les anticorps neutralisants, avaient un titre
faible et n'ont pas semblé avoir un impact cliniquement significatif
sur l'efficacité ou la sécurité de l'alirocumab, à l'exception d'un
taux plus élevé de réactions au site d'injection chez les patients
ayant présenté des ADA sous traitement, comparativement aux patients
n'ayant pas présenté d' ADA (7,5 % versus 3,6 %). Les conséquences à
long terme de la poursuite du traitement par alirocumab en présence
d'ADA sont inconnues.
Dans un groupe de dix essais contrôlés versus placebo et versus
substance active dans lesquels les patients étaient traités par
alirocumab 75 mg et/ou 150 mg Q2S, ainsi que dans une étude clinique
distincte dans laquelle les patients étaient traités par alirocumab 75
mg Q2S ou 300 mg toutes les 4 semaines (incluant certains patients dont
la dose a été ajustée à 150 mg Q2S), l'incidence de détection d'ADA et
d'AcN était similaires aux résultats de l'essai ODYSSEY OUTCOMES décrit
ci-dessus.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration - voir Annexe V.
ARRETER LE TRAITEMENT ET CONSULTER IMMEDIATEMENT LE MEDECIN en cas de réaction allergique grave avec des symptômes tels que :
- difficultés à respirer, ou gonflement du visage, des lèvres, de la gorge ou de la langue,
- tâches rouges sur la peau avec parfois des cloques,
- diarrhée, éruption cutanée ou tâches de couleur violette sur la peau.
Grossesse
Il n'existe pas de données sur l'utilisation de Praluent chez la femme enceinte. L'alirocumab étant un anticorps IgG1 recombinant, il est susceptible de traverser la barrière placentaire (voir rubrique Données de sécurité préclinique). Les études menées chez l'animal n'ont pas montré d'effets nocifs directs ou indirects sur la poursuite de la gestation ou le développement embryo-fœtal ; une toxicité maternelle a été notée chez les rats, mais pas chez les singes, à des doses supérieures aux doses thérapeutiques chez l'homme, et une réponse immunitaire secondaire plus faible après provocation antigénique a été observée chez la descendance des singes (voir rubrique Données de sécurité préclinique).
L'utilisation de Praluent n'est pas recommandée pendant la grossesse sauf si l'état clinique de la femme nécessite un traitement par l'alirocumab.
Allaitement
On ne sait pas si l'alirocumab est excrété dans le lait maternel. L'immunoglobuline (IgG) humaine est excrétée dans le lait maternel, en particulier dans le colostrum. L'utilisation de Praluent n'est pas recommandée à cette période chez les femmes allaitantes. Pour le reste de la durée de l'allaitement, une faible exposition est attendue. Les effets de l'alirocumab sur les enfants allaités n'étant pas connus, une décision doit être prise soit d'interrompre l'allaitement, soit d'interrompre le traitement par Praluent durant cette période.
Fertilité
Aucun effet indésirable sur les marqueurs de la fertilité n'a été observé dans les études animales (voir rubrique Données de sécurité préclinique). Aucune donnée n'est disponible concernant les effets indésirables sur la fertilité humaine.
Effets d'alirocumab sur d'autres médicaments
L'alirocumab étant un agent biologique, aucun effet pharmacocinétique d'alirocumab sur d'autres médicaments ni aucun effet sur les enzymes du cytochrome P450 ne sont attendus.
Effets d'autres médicaments sur l'alirocumab
Les statines et autres traitements hypolipémiants sont connus pour augmenter la production de PCSK9, la protéine ciblée par l'alirocumab. Cela entraîne une augmentation de la clairance d'alirocumab médiée par PCSK9 et diminue l'exposition systémique à l'alirocumab. Comparativement à l'alirocumab en monothérapie, l'exposition à l'alirocumab est environ 40 %, 15 % et 35 % moins élevée lorsqu'il est utilisé de façon concomitante avec respectivement des statines, de l'ézétimibe et du fénofibrate. Cependant, la diminution du taux de LDL-C est maintenue durant l'intervalle entre les administrations lorsque l'alirocumab est administré toutes les deux semaines.
Posologie
Adultes
Avant de débuter un traitement par alirocumab, toute cause secondaire
d'hypercholestérolémie ou de dyslipidémie mixte doit être éliminée (par
ex. syndrome néphrotique, hypothyroïdie).
La dose initiale habituelle d'alirocumab est de 75 mg administrée par voie sous-cutanée une fois toutes les 2 semaines. Les patients qui nécessitent une diminution plus importante du taux de LDL-C (> 60 %) peuvent démarrer le traitement à la dose de 150 mg une fois toutes les 2 semaines ou 300 mg une fois toutes les 4 semaines (mensuellement) administrée par voie sous-cutanée.
La dose d'alirocumab peut être ajustée individuellement en fonction des caractéristiques du patient telles que son taux de LDL-C avant traitement, son objectif thérapeutique et sa réponse au traitement. Les paramètres lipidiques peuvent être évalués 4 à 8 semaines après l'instauration ou l'ajustement posologique du traitement, la posologie pouvant alors être ajustée en fonction des résultats (augmentation ou diminution de la dose le cas échéant). Si une réduction supplémentaire du cholestérol LDL est nécessaire chez les patients traités avec 75 mg toutes les 2 semaines ou 300 mg toutes les 4 semaines (mensuellement), la posologie peut être ajustée à la dose maximale de 150 mg toutes les 2 semaines.
Hypercholestérolémie familiale hétérozygote chez les patients pédiatriques à partir de 8 ans
| Poids corporel des patients | Dose recommandée | Dose recommandée si une réduction supplémentaire du LDL-C est nécessaire* |
| Moins de 50 kg | 150 mg une fois toutes les 4 semaines | 75 mg une fois toutes les 2 semaines |
| 50 kg ou plus | 300 mg une fois toutes les 4 semaines | 150 mg une fois toutes les 2 semaines |
*Les
taux de lipides peuvent être réévalués 8 semaines après l'initiation ou
la titration du traitement et la dose peut être ajustée en conséquence.
Dose oubliée
En
cas d'oubli d'une dose, la dose doit être administrée dès que possible,
puis le traitement doit être repris selon le schéma posologique initial.
Populations particulières
Personnes âgées
Aucun ajustement posologique n'est nécessaire chez les patients âgés.
Insuffisance hépatique
Aucun
ajustement posologique n'est nécessaire chez les patients atteints
d'insuffisance hépatique légère à modérée. Aucune donnée n'est
disponible pour les patients atteints d'insuffisance hépatique sévère
(voir rubrique Propriétés pharmacocinétiques).
Insuffisance rénale
Aucun
ajustement posologique n'est nécessaire chez les patients atteints
d'insuffisance rénale légère à modérée. Peu de données sont disponibles
chez les patients atteints d'insuffisance rénale sévère (voir rubrique Propriétés pharmacocinétiques).
Poids corporel
Aucun ajustement posologique n'est nécessaire en fonction du poids des patients.
Population pédiatrique
La
sécurité et l'efficacité de Praluent chez les enfants âgés de moins de
8 ans n'ont pas été établies. Aucune donnée n'est disponible.
Mode d'administration
Voie sous-cutanée.
L'alirocumab est administré par injection sous-cutanée dans la cuisse, l'abdomen ou le haut du bras. Chaque stylo pré-rempli ou seringue pré-remplie est à usage unique exclusivement.
Pour
administrer la dose de 300 mg, une injection de 300 mg, ou deux
injections de 150 mg consécutives sur deux sites d'injection différents
doivent être effectuées.
Il est recommandé d'alterner les sites d'injection à chaque injection.
L'alirocumab ne doit pas être injecté dans des zones d'affections cutanées actives ou dans des zones lésées, telles qu'érythèmes solaires, éruptions cutanées, zones inflammatoires ou infectées.
L'alirocumab ne doit pas être administré en même temps que d'autres médicaments injectables au même site d'injection.
Précautions à prendre avant la manipulation ou l'administration
La solution doit être amené à température ambiante avant l'utilisation (voir rubrique Précautions particulières d'élimination et de manipulation).
Population pédiatrique à partir de 8 ans
Chez les adolescents à partir de 12 ans, il est recommandé d'administrer Praluent par ou sous la supervisison d'un adulte.
Chez les enfants de moins de 12 ans, Praluent doit être administré par un soignant ou un accompagnant.
Adultes
Après
une formation sur la bonne technique d'injection sous-cutanée par un
professionnel de santé, le patient adulte peut s'injecter lui-même
l'alirocumab ou un soignant ou un accompagnant peut le lui administrer.
Durée de conservation :
2 ans
Précautions particulières de conservation :
À conserver au réfrigérateur (entre + 2 °C et + 8 °C). Ne pas congeler.
Praluent peut être conservé en dehors du réfrigérateur à une
température ne dépassant pas 25°C et à l'abri de la lumière jusqu'à 30
jours maximum en une seule période. Une fois sorti du réfrigérateur, le
médicament doit être utilisé dans les 30 jours ou éliminé.
À conserver dans l'emballage d'origine à l'abri de la lumière.
En l'absence d'études de compatibilité, ce médicament ne doit pas être mélangé avec d'autres médicaments.
Il n'y a pas de traitement spécifique du surdosage de l'alirocumab. En cas de surdosage, le patient doit recevoir un traitement symptomatique, et des mesures appropriées doivent être instaurées si besoin.
Classe pharmacothérapeutique : agents modifiant les lipides, autres agents modifiant les lipides. Code ATC : C10AX14
Mécanisme d'action
L'alirocumab est un anticorps monoclonal IgG1 entièrement humain qui se lie avec une haute affinité et une haute spécificité à la proprotéine convertase subtilisine/kexine de type 9 (PCSK9). PCSK9 se lie aux récepteurs au LDL-C présents à la surface des hépatocytes et favorise leur dégradation dans le foie. Les récepteurs au LDL-C captent les LDL-C circulants. Par conséquent, la diminution du nombre des récepteurs au LDL-C par PCSK9 entraîne une augmentation du LDL-C dans le sang. En empêchant PCSK9 de se lier aux récepteurs au LDL-C, l'alirocumab augmente le nombre de récepteurs disponibles pour capter le LDL-C circulant et permet donc de diminuer le taux de LDL-C dans le sang.
Les récepteurs au LDL-C se lient également à des VLDL riches en triglycérides (lipoprotéines de très faible densité) et IDL (lipoprotéines de densité intermédiaire). Ainsi, l'alirocumab permet une réduction des autres lipoprotéines comme le montrent les réductions sur les taux d'Apo B, de non HDL-C et de TG. L'alirocumab entraîne également une réduction des taux de lipoprotéine (a) [Lp(a)], qui est une forme de LDL-C liée à l'apolipoprotéine (a). Toutefois, les récepteurs au LDL-C ayant une faible affinité pour la Lp(a), le mécanisme exact selon lequel l'alirocumab baisse le taux de Lp(a) n'est donc pas entièrement compris.
Dans les études génétiques menées chez l'homme, des mutations « perte de fonction » ou « gain de fonction » de PCSK9 ont été identifiées. Les personnes présentant une mutation « perte de fonction » de PCSK9 sur un allèle unique présentent des taux de LDL-C plus bas. Ces taux plus bas sont corrélés à une incidence significativement plus faible de coronaropathie. Quelques personnes présentant des mutations « perte de fonction » de PCSK9 sur deux allèles et ayant des taux de LDL-C particulièrement bas ont été identifiées avec des taux normaux de HDL-C et de TG. Inversement, des mutations « gain de fonction » de PCSK9 ont été identifiées chez des patients présentant une augmentation des taux de LDL-C et un diagnostic clinique d'hypercholestérolémie familiale.
Dans une étude multicentrique, en double aveugle, contrôlée versus placebo de 14 semaines, 13 patients présentant une hypercholestérolémie familiale hétérozygote (heFH) due à des mutations « gain de fonction » de PCSK9 ont été randomisés pour recevoir 150 mg d'alirocumab toutes les 2 semaines ou un placebo. Le taux de LDL-C moyen à l'initiation était de 1,52 g/L (3,90 mmol/L). À la semaine 2, la réduction moyenne par rapport au taux de LDL-C à l'initiation était de 62,5 % chez les patients traités par l'alirocumab, versus 8,8 % chez les patients traités par placebo. À la semaine 8, la réduction moyenne des taux de LDL-C par rapport à l'initiation chez tous les patients traités par l'alirocumab était de 72,4 %.
Effets pharmacodynamiques
Dans les essais in vitro, en présence ou non de PCSK9, l'alirocumab n'a pas induit d'activité de fonction cellulaire effectrice médiée par la portion Fc (toxicité à médiation cellulaire dépendante des anticorps et toxicité dépendant du complément) et aucun complexe immun soluble capable de lier les protéines du complément n'a été observé pour l'alirocumab lorsqu'il est lié à PCSK9.
Efficacité et sécurité clinique dans l'hypercholestérolémie primaire et la dyslipidémie mixte
Résumé du programme d'essais cliniques de phase 3 (schéma posologique de 75 mg et/ou 150 mg toutes les 2 semaines)
L'efficacité de l'alirocumab a été étudiée dans dix essais de phase 3 (cinq études contrôlées versus placebo et cinq études contrôlées versus ézétimibe), ayant inclus 5 296 patients présentant une hypercholestérolémie (non familiale et familiale hétérozygote) ou une dyslipidémie mixte, dont 3 188 patients randomisés dans le groupe alirocumab. Dans les études de phase 3, 31 % des patients avaient un diabète de type 2, et 64 % des patients avaient des antécédents de coronaropathie. Trois des dix études ont été menées exclusivement chez des patients présentant une hypercholestérolémie familiale hétérozygote (heFH). La majorité des patients participant au programme de phase 3 prenait un traitement hypolipémiant consistant en une statine à la dose maximale tolérée, avec ou sans autre traitement hypolipémiant, et était à haut ou très haut risque cardiovasculaire (CV). Deux études ont été menées chez des patients qui n'étaient pas traités par statine, dont une chez des patients présentant une intolérance aux statines documentée.
Deux études (l'étude LONG TERM et l'étude HIGH FH), impliquant un total de 2 416 patients, ont été menées avec uniquement la dose de 150 mg toutes les 2 semaines. Huit études ont été menées avec une dose de 75 mg toutes les 2 semaines, et avec une augmentation de la posologie à la semaine 12 basée sur des critères préétablis à la dose de 150 mg toutes les 2 semaines chez les patients qui n'atteignaient pas à la semaine 8 leur objectif thérapeutique de LDL-C préalablement défini en fonction de leur niveau de risque CV.
Le critère principal d'efficacité dans toutes les études de phase 3 était le pourcentage moyen de réduction du taux de LDL-C entre l'initiation et la semaine 24, comparativement au placebo ou à l'ézétimibe. Toutes les études ont atteint leur critère principal de jugement. En général, l'administration de l'alirocumab a également entraîné une réduction plus importante et statistiquement significative en pourcentage du taux de cholestérol total (CT), du taux de non HDL-C, du taux d'Apo B et du taux de lipoprotéine (a) [Lp(a)], comparativement au placebo ou à l'ézétimibe, que les patients soient traités ou non par statine. L'alirocumab a également réduit les taux de triglycérides (TG) et augmenté les taux de HDL-C et d'Apo A-1 comparativement au placebo. Pour les résultats détaillés, consulter le tableau 2. Une réduction du taux de LDL-C a été observée quel que soit l'âge, le sexe, l'indice de masse corporelle (IMC), l'origine ethnique, le taux de LDL-C à l'initiation, chez les patients présentant ou ne présentant pas une heFH, chez les patients présentant une dyslipidémie mixte et chez les patients diabétiques. Bien qu'une efficacité similaire ait été observée chez les patients âgés de plus de 75 ans, les données sont limitées pour ce groupe d'âge. La réduction des taux de LDL-C était constante, quelles que soient les statines utilisées et leur dose. Une proportion significativement plus élevée de patients a atteint des taux de LDL-C < 0,7 g/L (< 1,81 mmol/L) dans le groupe alirocumab comparativement au groupe placebo ou ézétimibe à la semaine 12 et à la semaine 24. Dans les études utilisant le schéma d'augmentation de la dose selon des critères préétablis, la majorité des patients a atteint l'objectif thérapeutique de LDL-C préalablement défini (en fonction de leur niveau de risque CV) à la dose de 75 mg toutes les 2 semaines, et la majorité des patients a poursuivi le traitement à la dose de 75 mg toutes les 2 semaines. L'effet hypolipémiant de l'alirocumab a été observé dans les 15 jours suivant l'administration de la première dose, l'effet maximal étant atteint au bout d'environ 4 semaines. Avec un traitement à long terme, l'efficacité s'est maintenue sur toute la durée des études (jusqu'à2 ans). Après l'arrêt du traitement par l'alirocumab, aucun rebond du taux de LDL-C n'a été observé, et les taux de LDL-C sont progressivement revenus aux taux à l'initiation.
Dans
une analyse pré-spécifiée de 8 études où les patients débutaient le traitement
à la dose de 75 mg toutes les deux semaines et avant l'augmentation possible de
la dose à la semaine 12, la réduction moyenne des taux de LDL-C était comprise
entre 44,5 % et 49,2 %. Dans les 2 études où les patients ont débuté et poursuivi
le traitement à la dose de 150 mg toutes les 2 semaines, la réduction moyenne à
la semaine 12 était de 62,6 %. Dans une analyse poolée
des études de phase 3 où une augmentation de la dose était possible, une
augmentation de la posologie de 75 mg toutes les 2 semaines à 150 mg toutes les
2 semaines, dans le sous- groupe de patients où la dose avait été augmentée, a
entraîné une réduction moyenne supplémentaire de 14 % du taux de LDL-C chez les
patients déjà traités par statine. Chez les patients qui n'étaient pas traités
par statine, l'augmentation de la dose de l'alirocumab
a entraîné une réduction supplémentaire moyenne de 3 % du taux de LDL-C, avec la
majorité des effets observés chez approximativement 25% des patients qui ont
atteint une diminution supplémentaire du taux de LDL-C d'au moins 10 % après
l'augmentation de la dose.
Les
patients dont la dose avait été augmentée à 150 mg toutes les 2 semaines
avaient un taux moyen de LDL-C plus élevé à l'initiation.
Évaluation des événements cardiovasculaires (CV)
Dans une analyse pré-spécifiée et poolée des études de phase 3, les événements CV survenus au cours du traitement et confirmés par adjudication, comprenant décès par coronaropathie, infarctus du myocarde, accident vasculaire cérébral ischémique, angor instable nécessitant une hospitalisation, hospitalisation pour une insuffisance cardiaque congestive, et procédures de revascularisation, ont été rapportés chez 110 (3,5 %) patients du groupe alirocumab et chez 53 (3,0 %) patients du groupe contrôle (placebo ou contrôle actif) avec un risque relatif (RR) = 1,08 (IC à 95 %, de 0,78 à 1,50). Les événements cardiovasculaires majeurs (« MACE-plus », c'est à dire : décès par coronaropathie, infarctus du myocarde, accident vasculaire cérébral ischémique et angor instable nécessitant une hospitalisation) confirmés par adjudication ont été rapportés chez 52 des 3 182 (1,6 %) patients du groupe alirocumab et chez 33 des 1 792 (1,8 %) patients du groupe contrôle (placebo ou contrôle actif) ; RR = 0,81 (IC à 95 %, de 0,52 à 1,25).
Dans les analyses finales pré-spécifiées de l'étude LONG TERM, les événements CV survenus sous traitement et confirmés par adjudication ont été rapportés chez 72 des 1 550 (4,6 %) patients du groupe alirocumab et chez 40 des 788 (5,1 %) patients du groupe placebo ; les événements cardiovasculaires majeurs (MACE-plus) confirmés par adjudication ont été rapportés chez 27 des 1 550 (1,7 %) patients du groupe alirocumab et chez 26 des 788 (3,3 %) patients du groupe placebo. Le risque relatif a été calculé en post-hoc ; pour tous les événements CV, RR = 0,91 (IC à 95 %, de 0,62 à 1,34) ; pour les MACE-plus, RR = 0,52 (IC à 95 %, de 0,31 à 0,90).
Mortalité toutes causes confondues
La mortalité toutes causes confondues dans les études de phase 3 était de 0,6 % (20 patients sur 3 182) dans le groupe alirocumab et de 0,9 % (17 patients sur 1 792) dans le groupe contrôle. La cause principale de décès chez la majorité de ces patients était un événement CV.
Traitement en association avec une statine
Études de phase 3 contrôlées versus placebo (sous traitement de fond par statine) chez des patients présentant une hypercholestérolémie primaire ou une dyslipidémie mixte
Étude LONG TERM
Cette étude multicentrique, en double aveugle, contrôlée versus placebo, d'une durée de 18 mois, a inclus 2 310 patients présentant une hypercholestérolémie primaire, à haut ou très haut risque CV et traités par une statine à la dose maximale tolérée, avec ou sans autre traitement hypolipémiant. En plus de leur traitement hypolipémiant existant, les patients ont reçu soit l'alirocumab à la dose de 150 mg toutes les 2 semaines soit un placebo. Parmi les patients inclus dans l'étude LONG TERM, 17,7 % des patients présentaient une heFH, 34,6 % des patients avaient un diabète de type 2 et 68,6 % de patients avaient des antécédents de coronaropathie. À la semaine 24, la différence moyenne de réduction du LDL-C entre le groupe alirocumab et le groupe placebo était 61,9 % (IC à 95 % : -64,3 %, -59,4 % ; valeur p : < 0,0001). Pour les résultats détaillés, consultez le Tableau 2. À la semaine 12, 82,1 % des patients du groupe alirocumab avaient atteint un taux de LDL-C < 0,7 g/L (< 1,81 mmol/L) versus 7,2 % des patients du groupe placebo. La différence par rapport au placebo était statistiquement significative à la semaine 24 pour tous les lipides/lipoprotéines.
Étude COMBO I
Une étude multicentrique, en double aveugle, contrôlée versus placebo de 52 semaines a inclus 311 patients à très haut risque CV et n'ayant pas atteint leur objectif thérapeutique de LDL-C prédéfini sous une statine à la dose maximale tolérée, avec ou sans autre traitement hypolipémiant. En plus de leur traitement hypolipémiant existant, les patients recevaient soit l'alirocumab à la dose de 75 mg toutes les 2 semaines, soit un placebo. L'augmentation de la posologie de l'alirocumab à la dose de 150 mg toutes les 2 semaines avait lieu à la semaine 12 chez les patients dont les taux de LDL-C étaient ≥ 0,7 g/L (≥ 1,81 mmol/L). À la semaine 24, la différence moyenne de réduction du LDL-C entre le groupe alirocumab et le groupe placebo était 45,9 % (IC à 95 % : -52,5 %, -39,3 % ; valeur p : < 0,0001). Pour les résultats détaillés, consulter le Tableau 2. À la semaine 12 (avant l'augmentation de la posologie), 76,0 % des patients du groupe alirocumab avaient atteint un taux de LDL-C < 0,7 g/L (< 1,81 mmol/L) versus 11,3 % des patients du groupe placebo. La dose a été augmentée à 150 mg toutes les 2 semaines chez 32 (16,8 %) patients traités au- delà de 12 semaines. Dans le sous-groupe des patients où la dose a été augmentée à la semaine 12, une réduction moyenne supplémentaire du taux de LDL-C de 22,8 % a été atteinte à la semaine 24. La différence par rapport au placebo était statistiquement significative à la semaine 24 pour tous les lipides/lipoprotéines sauf les taux de TG et d'Apo A-1.
Études de phase 3 contrôlées versus placebo (patients traités par statine) chez des patients présentant une hypercholestérolémie familiale hétérozygote (heFH)
Études FH I et FH II
Deux études multicentriques, contrôlées versus placebo, en double aveugle, de 18 mois ont inclus 732 patients présentant une heFH et recevant une statine à la dose maximale tolérée, avec ou sans autre traitement hypolipémiant. Les patients recevaient soit l'alirocumab à la dose de 75 mg toutes les 2 semaines, soit un placebo, en plus de leur traitement hypolipémiant existant. L'augmentation de la posologie de l'alirocumab à la dose de 150 mg toutes les 2 semaines avait lieu à la semaine 12 chez les patients dont les taux de LDL-C étaient ≥ 0,7 g/L (≥ 1,81 mmol/L). À la semaine 24, la différence moyenne de réduction du LDL-C entre le groupe alirocumab et le groupe placebo était 55,8 % (IC à 95 % : -60,0 %, -51,6 % ; valeur p : < 0,0001). Pour les résultats détaillés, consulter le Tableau 2. À la semaine 12 (avant l'augmentation de la posologie), 50,2 % des patients du groupe alirocumab avaient atteint un taux de LDL-C < 0,7 g/L (< 1,81 mmol/L) versus 0,6 % des patients du groupe placebo. Dans le sous-groupe des patients où la dose a été augmentée à la semaine 12, une réduction moyenne supplémentaire du taux de LDL-C de 15,7 % a été atteinte à la semaine 24. La différence versus placebo était statistiquement significative à la semaine 24 pour tous les lipides/lipoprotéines.
Étude HIGH FH
Une troisième étude multicentrique, en double aveugle, contrôlée versus placebo, de 18 mois a inclus 106 patients présentant une heFH et recevant une statine à la dose maximale tolérée, avec ou sans autre traitement hypolipémiant, et un taux initial de LDL-C ≥ 1,60 g/L (≥ 4,14 mmol/L). En plus de leur traitement hypolipémiant existant, les patients ont reçu soit l'alirocumab à la dose de 150 mg toutes les 2 semaines soit un placebo. Le taux initial moyen de LDL-C était de 1,96 g/L (5.07 mmol/L) dans le groupe alirocumab et de 2,01 g/L (5,20 mmol/L) dans le groupe placebo. À la semaine 24, la différence moyenne de réduction du taux de LDL-C entre le groupe alirocumab et le groupe placebo était 39,1 % (IC à 95 % : -51,1 %, -27,1 % ; valeur p : < 0,0001). Pour les résultats détaillés, consulter le Tableau 2. Les changements moyens pour tous les autres taux de lipides/lipoprotéines étaient similaires à ceux des études FH I et FH II, cependant la significativité statistique n'a pas été atteinte pour les taux de TG, de HDL-C et d'Apo A-1.
Étude de phase 3 contrôlée versus ézétimibe (patients traités par statine) chez des patients présentant une hypercholestérolémie primaire ou une dyslipidémie mixte
Étude COMBO II
Une étude multicentrique, en double aveugle, contrôlée versus ézétimibe, d'une durée de 2 ans, a inclus 707 patients à très haut risque CV et n'ayant pas atteint leur objectif thérapeutique de LDL-C prédéfini sous une statine à la dose maximale tolérée. Les patients recevaient soit l'alirocumab à la dose de 75 mg toutes les 2 semaines, soit de l'ézétimibe à la dose de 10 mg une fois par jour en plus de leur traitement par statine existant. L'augmentation de la posologie de l'alirocumab à la dose de 150 mg toutes les 2 semaines avait lieu à la semaine 12 chez les patients dont les taux de LDL-C étaient ≥ 0,7 g/L (≥ 1,81 mmol/L). À la semaine 24, la différence moyenne de réduction du LDL-C entre le groupe alirocumab et le groupe ézétimibe était 29,8 % (IC à 95 % : -34,4 %, -25,3 % ; valeur p : < 0,0001). Pour les résultats détaillés, consultez le Tableau 2. À la semaine 12 (avant l'augmentation de la posologie), 77,2 % des patients du groupe alirocumab avaient atteint un taux de LDL-C < 0,7 g/L (< 1,81 mmol/L) versus 46,2 % des patients du groupe ézétimibe. Dans le sous- groupe des patients où la dose a été augmentée à la semaine 12, une réduction moyenne supplémentaire du taux de LDL-C de 10,5 % a été atteinte à la semaine 24. La différence versus ézétimibe était statistiquement significative à la semaine 24 pour tous les lipides/lipoprotéines, à l'exception des TG et de l'Apo A-1.
En monothérapie ou en association à un traitement hypolipémiant autre qu'une statine
Essais de phase 3 contrôlés versus ézétimibe chez des patients présentant une hypercholestérolémie primaire (patients non traités par statine)
Étude ALTERNATIVE
Une étude multicentrique, en double aveugle, contrôlée versus ézétimibe, de 24 semaines, a inclus 248 patients présentant une intolérance aux statines documentée liée à des symptômes musculo-squelettiques. Les patients recevaient soit l'alirocumab à la dose de 75 mg toutes les 2 semaines, soit de l'ézétimibe à la dose de 10 mg une fois par jour, ou de l'atorvastatine à la dose de 20 mg une fois par jour (comme bras de nouvelle exposition aux statines « re-challenge arm »). L'augmentation de la posologie de l'alirocumab à la dose de 150 mg toutes les 2 semaines a eu lieu à la semaine 12 chez les patients dont les taux de LDL-C étaient ≥ 0,7 g/L (≥ 1,81 mmol/L) ou ≥ 1 g/L (≥ 2,59 mmol/L), selon leur niveau de risque CV. À la semaine 24, la différence moyenne de réduction du LDL-C entre le groupe alirocumab et le groupe ézétimibe était 30,4 % (IC à 95 % : -36,6 %, -24,2 % ; valeur p : < 0,0001). Pour les résultats détaillés, consulter le Tableau 2. À la semaine 12 (avant l'augmentation de la posologie), 34,9 % des patients avaient atteint un taux de LDL-C < 0,7 g/L (< 1,81 mmol/L) versus 0 % dans le groupe ézétimibe. Dans le sous-groupe des patients où la dose a été augmentée à la semaine 12, une réduction moyenne supplémentaire du taux de LDL-C de 3,6 % a été atteinte à la semaine 24. La différence versus ézétimibe était statistiquement significative à la semaine 24 pour les taux de LDL-C, de CT, de non HDL-C, d'Apo B, et de Lp(a).
Cet essai a évalué des patients qui ne toléraient pas au moins deux statines (dont au moins une à la dose approuvée la plus faible). Chez ces patients, des événements indésirables musculo-squelettiques sont survenus à un taux plus faible dans le groupe alirocumab (32,5 %) que dans le groupe atorvastatine (46,0 %) (RR = 0,61 [IC à 95 %, de 0,38 à 0,99]), et un pourcentage plus faible de patients dans le groupe alirocumab (15,9 %) a interrompu le traitement à l'étude en raison d'événements musculo-squelettiques, comparativement au groupe atorvastatine (22,2 %). Dans les cinq essais contrôlés versus placebo menés chez des patients recevant une statine à la dose maximale tolérée (n = 3 752), le taux d'interruption du traitement en raison d'événements indésirables musculo-squelettiques était de 0,4 % dans le groupe alirocumab et de 0,5 % dans le groupe placebo.
Étude MONO
Une étude multicentrique, en double aveugle, contrôlée versus ézétimibe, de 24 semaines a inclus 103 patients présentant un risque CV modéré, ne prenant pas de statine ni d'autre traitement hypolipémiant, et dont le taux de LDL-C à l'initiation se situait entre 1 g/L (2,59 mmol/L) et 1,9 g/L (4,91 mmol/L). Les patients recevaient soit l'alirocumab à la dose de 75 mg toutes les 2 semaines, soit de l'ézétimibe à la dose de 10 mg une fois par jour. L'augmentation de la posologie de l'alirocumab à la dose de 150 mg toutes les 2 semaines avait lieu à la semaine 12 chez les patients dont les taux de LDL-C étaient ≥ 0,7 g/L (1,81 mmol/L). À la semaine 24, la différence moyenne de réduction du LDL-C entre le groupe alirocumab et le groupe ézétimibe était 31,6 % (IC à 95 % : -40,2 %, -23,0 % ; valeur p : < 0,0001). Pour les résultats détaillés, consulter le Tableau 2. À la semaine 12 (avant l'augmentation de la posologie), 57,7 % des patients avaient atteint un taux de LDL-C < 0,7 g/L (< 1,81 mmol/L) versus 0 % dans le groupe ézétimibe. La dose a été augmentée à 150 mg toutes les 2 semaines chez 14 (30,4 %) patients traités au-delà de 12 semaines. Dans le sous-groupe des patients où la dose a été augmentée à la semaine 12, une réduction moyenne supplémentaire du taux de LDL-C de 1,4 % a été atteinte à la semaine 24. La différence versus ézétimibe était statistiquement significative à la semaine 24 pour les taux de LDL-C, de CT, de non HDL-C et d'Apo B.
Tableau 2 : Variation moyenne en pourcentage, par rapport à l'initiation, des taux de LDL-C et des autres lipides/lipoprotéines dans les études contrôlées versus placebo et les études contrôlées versus ézétimibe - Schéma posologique 75 mg et/ou 150 mg toutes les 2 semaines
| Variation moyenne en pourcentage, par rapport à l'initiation, dans les études contrôlées versus placebo (patients traités par statine) | ||||||||||||||
|
Étude LONG TERM
(N = 2 310) |
FHI et FHII
(N = 732) |
High FH
(N = 106) |
COMBO I
(N = 311) |
|||||||||||
| Placebo | Alirocumab | Placebo | Alirocumab | Placebo | Alirocumab | Placebo | Alirocumab | |||||||
|
Nombre
de patients |
780 | 1530 | 244 | 488 | 35 | 71 | 106 | 205 | ||||||
|
Taux
moyen de LDL-C en mg/dL (mmol/L) à l'initiation |
122,0
(3,16) |
122,8
(3,18) |
140,9
(3,65) |
141,3
(3,66) |
201,0
(5,21) |
196,3
(5,10) |
104,6
(2,71) |
100,3 (2,60) |
||||||
| Semaine 12 | ||||||||||||||
|
LDL-C
(ITT)a |
1,5 | -63,3 | 5,4 | -43,6 | -6,6 | -46,9 | 1,1 | -46,3 | ||||||
|
LDL-C
(per protocole)b |
1,4 | -64,2 | 5,3 | -44,0 | -6,6 | -46,9 | 1,7 | -47,6 | ||||||
| Semaine 24 | ||||||||||||||
|
LDL-C
(ITT)a |
0,8 | -61,0c | 7,1 | -48,8d | -6,6 | -45,7e | -2,3 | -48,2f | ||||||
|
LDL-C
(per protocol)b |
0,7 | -62,8 | 6,8 | -49,3 | -6,6 | -45,5 | -0,8 | -50,7 | ||||||
|
Non
HDL-C |
0,7 | -51,6 | 7,4 | -42,8 | -6,2 | -41,9 | -1,6 | -39,1 | ||||||
| Apo B | 1,2 | -52,8 | 1,9 | -41,7 | -8,7 | -39,0 | -0,9 | -36,7 | ||||||
| CT | -0,3 | -37,8 | 5,5 | -31,2 | -4,8 | -33,2 | -2,9 | -27,9 | ||||||
| Lp(a) | -3,7 | -29,3 | -8,5 | -26,9 | -8,7 | -23,5 | -5,9 | -20,5 | ||||||
| TG | 1,8 | -15,6 | 4,3 | -9,8 | -1,9 | -10,5 | -5,4 | -6,0 | ||||||
| HDL-C | -0,6 | 4,0 | 0,2 | 7,8 | 3,9 | 7,5 | -3,8 | 3,5 | ||||||
| Apo A-1 | 1,2 | 4,0 | -0,4 | 4,2 | 2,0 | 5,6 | -2,5 | 3,3 | ||||||
| Variation moyenne en pourcentage par rapport à l'initiation dans les études contrôlées versus ézétimibe | ||||||||||||||
|
|
||||||||||||||
|
|
Avec traitement parstatine | Sans traitement par statine | ||||||||||||
|
|
COMBO II
(N = 77) |
ALTERNATIVE
(N = 248) |
MONO
(N = 103) |
|||||||||||
|
|
Ézétimibe | Alirocumab | Ézétimibe | Alirocumab | Ézétimibe | Alirocumab | ||||||||
| Nombre de patients | 240 | 467 | 122 | 126 | 51 | 52 | ||||||||
|
LDL-C
initial
en mg/dL (mmol/L) |
104,5
(2,71) |
108,3
(2,81) |
194,2
(5,03) |
191,1
(5,0) |
138,3
(3,58) |
141,1
(3,65) |
||||||||
| Semaine 12 | ||||||||||||||
| LDL-C (ITT)a | -21,8 | -51,2 | -15,6 | -47,0 | -19,6 | -48,1 | ||||||||
|
LDL-C (per protocole)b |
-22,7 | -52,4 | -18,0 | -51,2 | -20,4 | -53,2 | ||||||||
| Semaine 24 | ||||||||||||||
| LDL-C (ITT)a | -20,7 | -50,6g | -14,6 | -45,0h | -15,6 | -47,2i | ||||||||
|
LDL-C (per protocole)b |
-21,8 | -52,4 | -17,1 | -52,2 | -17,2 | -54,1 | ||||||||
| non HDL-C | -19,2 | -42,1 | -14,6 | -40,2 | -15,1 | -40,6 | ||||||||
| Apo B | -18,3 | -40,7 | -11,2 | -36,3 | -11,0 | -36,7 | ||||||||
| CT | -14,6 | -29,3 | -10,9 | -31,8 | -10,9 | -29,6 | ||||||||
| Lp(a) | -6,1 | -27,8 | -7,3 | -25,9 | -12,3 | -16,7 | ||||||||
| TG | -12,8 | -13,0 | -3,6 | -9,3 | -10,8 | -11,9 | ||||||||
| HDL-C | 0,5 | 8,6 | 6,8 | 7,7 | 1,6 | 6,0 | ||||||||
| Apo A-1 | -1,3 | 5,0 | 2,9 | 4,8 | -0,6 | 4,7 | ||||||||
a Analyse ITT -
population en intention de traiter, comprend toutes les données relatives aux
taux de lipides tout au long de l'étude, indépendamment de l'observance au
traitement à l'étude.
b Analyse per protocole - analyse restreinte à la période durant laquelle les patients ont réellement reçu le traitement.
La réduction en pourcentage du taux de LDL-C à la semaine 24 correspond à une réduction moyenne absolue de :
c-0,74 g/L (-1,92 mmol/L) ; d -0,71 g/L (-1,84 mmol/L) ; e -0,91 g/L (-2,35 mmol/L) ; f -0,50 g/L (-1,30 mmol/L) ;
g -0, 55 g/L (-1,44 mmol/L) ; h -0,84 g/L (-2,18 mmol/L) ; i-0,67 g/L (-1,73 mmol/L)
b Analyse per protocole - analyse restreinte à la période durant laquelle les patients ont réellement reçu le traitement.
La réduction en pourcentage du taux de LDL-C à la semaine 24 correspond à une réduction moyenne absolue de :
c-0,74 g/L (-1,92 mmol/L) ; d -0,71 g/L (-1,84 mmol/L) ; e -0,91 g/L (-2,35 mmol/L) ; f -0,50 g/L (-1,30 mmol/L) ;
g -0, 55 g/L (-1,44 mmol/L) ; h -0,84 g/L (-2,18 mmol/L) ; i-0,67 g/L (-1,73 mmol/L)
Schéma posologique toutes les 4 semaines
Étude CHOICE I
Une étude de 48 semaines multicentrique, en double insu, contrôlée versus placebo a inclus 540 patients prenant une statine à la dose maximale tolérée, avec ou sans autre hypolipémiant (308 dans le groupe alirocumab 300 mg toutes les 4 semaines, 76 dans le groupe alirocumab 75 mg toutes les 2 semaines et 156 dans le groupe placebo) et 252 patients non traités par statine (144 dans le groupe alirocumab 300 mg toutes les 4 semaines, 37 dans le groupe alirocumab 75 mg toutes les 2 semaines et 71 dans le groupe placebo). Les patients ont reçu soit 300 mg d'alirocumab toutes les 4 semaines, soit 75 mg d'alirocumab toutes les 2 semaines, soit un placebo en plus de leur traitement hypolipémiant existant (statine, traitement autre qu'une statine ou régime alimentaire uniquement). Les patients recevant alirocumab 300 mg toutes les 4 semaines ont reçu en alternance des injections de placebo pour maintenir l'insu au regard de la fréquence d'injection. Dans l'ensemble, 71,6 % des patients ont été classés comme présentant un haut ou très haut risque CV et n'atteignant pas leur objectif thérapeutique de LDL-C. Dans les bras recevant alirocumab, un ajustement posologique à 150 mg toutes les 2 semaines a été effectué à la semaine 12 chez les patients présentant un taux de LDL-C ≥ 70 mg/dL ou ≥ 100 mg/dL, selon leur niveau de risque CV, ou chez les patients dont le taux de LDL-C n'avait pas été réduit d'au moins 30 % par rapport à l'initiation.
Dans la cohorte des patients traités par statine, le taux moyen de LDL-C à l'initiation était de 112,7 mg/dL. À la semaine 12, la variation moyenne en pourcentage du taux de LDL-C par rapport à l'initiation avec 300 mg d'alirocumab toutes les 4 semaines (analyse de population en intention de traiter) était de -55,3 % versus +1,1 % avec le placebo. À la semaine 12 (avant ajustement posologique), 77,3 % des patients traités avec 300 mg d'alirocumab toutes les 4 semaines ont atteint un taux de LDL-C < 70 mg/dL versus 9,3 % dans le groupe placebo. À la semaine 24, la variation moyenne en pourcentage du taux de LDL-C par rapport à l'initiation avec 300 mg d'alirocumab toutes les 4 semaines et/ou 150 mg toutes les 2 semaines (analyse de population en intention de traiter) était de -58,8 % versus -0,1 % avec le placebo. À la semaine 24, la différence moyenne de réduction du LDL-C entre le groupe recevant 300 mg d'alirocumab toutes les 4 semaines et/ou 150 mg toutes les 2 semaines et le groupe placebo était de -58,7 % (IC à 97,5 % : -65,0 %, - 52,4 % ; valeur p : < 0,0001). Chez les patients traités au-delà de 12 semaines, la posologie a été ajustée à 150 mg toutes les 2 semaines chez 56 (19,3 %) des 290 patients dans le bras recevant 300 mg d'alirocumab toutes les 4 semaines. Dans le sous-groupe des patients dont la posologie a été ajustée à 150 mg toutes les2 semaines à la semaine 12, une réduction supplémentaire du taux de LDL-C de 25,4 % a été atteinte à la semaine 24.
Dans la cohorte des patients non traités en parallèle par statine, le taux moyen de LDL-C à l'initiation était de 142,1 mg/dL. À la semaine 12, la variation moyenne en pourcentage du taux de LDL-C par rapport à l'initiation avec 300 mg d'alirocumab toutes les 4 semaines (analyse de population en intention de traiter) était de -58,4 % versus +0,3 % pour le placebo. À la semaine 12 (avant ajustement posologique), 65,2 % des patients traités avec 300 mg d'alirocumab toutes les 4 semaines ont atteint un taux de LDL-C < 70 mg/dL versus 2,8 % dans le groupe placebo. À la semaine 24, la variation moyenne en pourcentage du taux de LDL- C par rapport à l'initiation avec 300 mg d'alirocumab toutes les 4 semaines et/ou 150 mg toutes les 2 semaines (analyse de population en intention de traiter) était de -52,7 % versus -0,3 % pour le placebo. À la semaine 24, la différence moyenne de réduction du LDL-C entre le groupe recevant 300 mg d'alirocumab toutes les 4 semaines et/ou 150 mg toutes les 2 semaines et le groupe placebo était de -52,4 % (IC à 97,5 % : -59,8 %, -45,0 % ; valeur p : < 0,0001). Chez les patients traités au-delà de 12 semaines, la posologie a été ajustée à 150 mg toutes les 2 semaines chez 19 (14,7 %) des 129 patients dans le bras recevant 300 mg d'alirocumab toutes les 4 semaines. Dans le sous-groupe des patients dont la posologie a été ajustée à 150 mg toutes les 2 semaines à la semaine 12, une réduction moyenne supplémentaire du taux de LDL-C de 7,3 % a été atteinte à la semaine 24.
Dans les deux cohortes, la différence par rapport au placebo était statistiquement significative à la semaine 24 pour tous les paramètres lipidiques, à l'exception de l'Apo A-1 dans le sous-groupe des patients traités conjointement par statine.
Efficacité et sécurité cliniques dans la prévention des événements cardiovasculaires
Étude ODYSSEY OUTCOMES
L'essai multicentrique, en double aveugle, contrôlé versus placebo, a inclus 18 924 patients adultes (9 462 sous alirocumab ; 9 462 sous placebo) suivis jusqu'à 5 ans. Les patients avaient présenté un syndrome coronaire aigu (SCA) entre 4 et 52 semaines avant la randomisation et étaient sous traitement hypolipémiant avec traitement intensif par statines (atorvastatine 40 ou 80 mg, ou rosuvastatine 20 ou 40 mg) ou à la dose maximale de statines tolérée, avec ou sans autre traitement hypolipémiant. Les patients ont été randomisés selon un rapport 1 :1 et recevaient soit 75 mg d'alirocumab une fois toutes les deux semaines (Q2S) soit un placebo Q2S. Si, au 2ème mois, une réduction supplémentaire du LDL-C était nécessaire en fonction des critères de LDL-C préspécifiés (LDL-C ≥ 50 mg/dl ou 1,29 mmol/dl), la dose d'alirocumab était ajustée à 150 mg Q2S. Pour les patients ayant reçu une dose ajustée à 150 mg Q2S et ayant présenté deux valeurs consécutives de LDL-C inférieures à 25 mg/dl (0,65 mmol/L), la dose était réduite de 150 mg Q2S à 75 mg Q2S. Les patients recevant 75 mg Q2S et ayant présenté deux valeurs consécutives de LDL-C inférieures à 15 mg/dl (0,39 mmol/l) étaient passés en aveugle vers un traitement placebo. Un ajustement de la dose à 150 mg Q2S a été nécessaire chez 2 615 (27,7 %) des 9 451 patients traités par alirocumab. Parmi ces 2 615 patients, la dose a été réduite à 75 mg Q2S pour 805 (30,8 %) d'entre eux. En tout, 730 (7,7 %) des 9 451 patients sont passés vers un traitement placebo. Au total, 99,5 % des patients ont été suivis jusqu'à la fin de l'essai pour l'évaluation de la survie. La durée de suivi médiane était de 33 mois.
L'événement index de SCA consistait en un infarctus du myocarde chez 83,2 % des patients (34,6 % STEMI [infarctus du myocarde avec surélévation du segment ST], 48,6 % NSTEMI [infarctus du myocarde sans élévation du segment ST]) et un épisode d'angor instable chez 16,8 % des patients. La plupart des patients (88,8 %) recevaient, à la randomisation, un traitement par statines d'intensité élevée, avec ou sans un autre traitement hypolipémiant. La valeur moyenne de LDL-C à l‘inclusion était de 92,4 mg/dl (2,39 mmol/l).
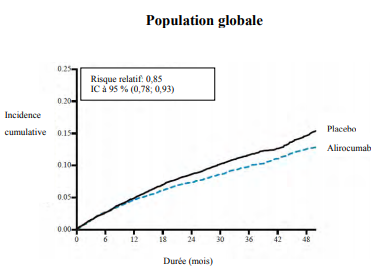
L'alirocumab a réduit significativement le risque de survenue du critère de jugement principal composite du délai de survenue d'un premier événement cardiovasculaire indésirable majeur (Major Adverse Cardiovascular Events, MACE-plus) consistant en : décès par coronaropathie, infarctus du myocarde (IM) non fatal, accident vasculaire cérébral (AVC) ischémique fatal et non fatal, ou angor instable (AI) nécessitant une hospitalisation (RR 0,85, IC à 95 % : 0,78, 0,93 ; valeur p = 0,0003). L'alirocumab a également réduit de manière significative les critères de jugement composites suivants : risque d'événement coronaires ; d'événement coronaire majeur ; d'événement cardiovasculaire ; ainsi que le critère composite de mortalité toutes causes, IM non fatal et AVC ischémique non fatal. Une réduction de la mortalité toutes causes a été également observée, avec une significativité statistique nominale, dans le cadre d'une procédure hiérarchisée de tests, (RR 0,85, IC à 95 % : 0,73, 0,98). Les résultats sont présentés dans le Tableau 3.
Tableau 3 : Efficacité de l'alirocumab dans l'étude ODYSSEY OUTCOMES (population globale)
| Critères d'évaluation | Nombre d'événements |
Risque relatif
(IC à 95 %) valeur de p |
||
|
Alirocumab
N = 9462 n (%) |
Placebo
N = 9462 n (%) |
|||
|
Critère
d'évaluation principal (MACE- plus)a |
903 (9,5 %) | 1052 (11,1 %) |
0,85 (0,78 ; 0,93)
0,0003 |

|
|
Décès par
coronaropathie |
205 (2,2 %) | 222 (2,3 %) |
0,92 (0,76 ; 1,11)
0,38 |
|
| IDM non fatal | 626 (6,6 %) | 722 (7,6 %) |
0.86 (0,77 ; 0.96)
0,006f |
|
| AVC ischémique | 111 (1,2 %) | 152 (1,6 %) |
0.73 (0,57 ; 0.93)
0,01f |
|
| Angor instableb | 37 (0,4 %) | 60 (0,6 %) |
0,61 (0,41 ; 0,92)
0,02f |
|
| Critères d'évaluation secondaires | ||||
| Événement coronairec | 1 199 (12,7 %) | 1 349 (14,3 %) |
0,88 (0,81 ; 0,95)
0,0013 |
|
|
Événement coronaire
majeurd |
793 (8,4 %) | 899 (9,5 %) |
0,88 (0,80 ; 0,96)
0,0060 |
|
|
Événement
cardiovasculairee |
1 301 (13,7 %) | 1 474 (15,6 %) |
0,87 (0,81 ; 0,94)
0,0003 |
|
|
Mortalité toutes
causes, IM non fatal, AVC ischémique non fatal |
973 (10,3 %) | 1 126 (11,9 %) |
0,86 (0,79 ; 0,93)
0,0003 |
|
|
Décès par
coronaropathie |
205 (2,2 %) | 222 (2,3 %) |
0,92 (0,76 ; 1,11)
0,3824 |
|
| Décès d'origine CV | 240 (2,5 %) | 271 (2,9 %) |
0,88 (0,74 ; 1,05)
0,1528 |
|
| Mortalité toutes causes | 334 (3,5 %) | 392 (4,1 %) |
0,85 (0,73 ; 0,98)
0,0261f |
|
a MACE-plus défini comme
composite de : décès par coronaropathie, infarctus du myocarde (IM) non fatal,
accident vasculaire cérébral (AVC) ischémique fatal et non fatal, ou angor
instable (AI) nécessitant une hospitalisation.
b Angor instable nécessitant une hospitalisation
c Événement coronaire défini comme suit : événement coronaire majeur d, angor instable nécessitant une hospitalisation, intervention de revascularisation coronaire due à une ischémie
d Événement coronaire majeur défini comme suit : décès par coronaropathie, IDM non fatal
e Événement cardiovasculaire défini comme suit : décès d'origine CV, tout événement coronaire non fatal, et AVC ischémique non fatal
f Valeur nominale
b Angor instable nécessitant une hospitalisation
c Événement coronaire défini comme suit : événement coronaire majeur d, angor instable nécessitant une hospitalisation, intervention de revascularisation coronaire due à une ischémie
d Événement coronaire majeur défini comme suit : décès par coronaropathie, IDM non fatal
e Événement cardiovasculaire défini comme suit : décès d'origine CV, tout événement coronaire non fatal, et AVC ischémique non fatal
f Valeur nominale
Les estimations de Kaplan-Meier de l'incidence cumulée du critère d'évaluation principal pour la population globale des patients au fil du temps sont présentées à la Figure 1.
Figure 1 Critère de jugement composite principal - Incidence cumulée sur 4 ans au cours de l'étude ODYSSEY OUTCOMES
Fonction neurocognitive
Un essai de 96 semaines, randomisé, en double aveugle et contrôlé versus placebo, a évalué l'effet de l'alirocumab sur la fonction neurocognitive après 96 semaines de traitement (~ 2 ans) chez des patients atteints d'hypercholestérolémie familiale hétérozygote (HeFH) ou d'hypercholestérolémie non familiale à risque cardiovasculaire élevé ou très élevé.
La fonction neurocognitive a été évaluée à l'aide de la Cambridge Neuropsychological Test Automated Battery (CANTAB). Un total de 2 171 patients a été randomisé ; 1 087 patients ont été traités par alirocumab 75 mg et/ou 150 mg toutes les 2 semaines et 1084 patients ont été traités par placebo. La majorité (> 80 %) des patients de chaque groupe a terminé la période de traitement en double aveugle de 96 semaines.
Au cours des 96 semaines de traitement, l'alirocumab n'a montré aucun effet sur la fonction neurocognitive. Le pourcentage de patients ayant présenté des troubles neurocognitifs était faible dans les groupes de traitement par l'alirocumab (1,3 %) et comparable à celui du placebo (1,7 %). Aucun problème de sécurité lié à la fonction neurocognitive n'a été observé chez les patients traités par alirocumab qui ont présenté soit 2 valeurs consécutives de LDL-C < 25 mg/dL (< 0,65 mmol/L), soit 2 valeurs consécutives de LDL-C < 15 mg/dL (< 0,39 mmol/L) pendant la période de traitement.
Population pédiatrique
Traitement de l'hypercholesterolémie familiale homozygote (HFHo) chez les patients pédiatriques
Une étude en ouvert de 48 semaines a été menée pour évaluer l'efficacité et la sécurité de l'alirocumab 75 mg une fois toutes les 2 semaines (Q2S) (si le poids corporel (PC) < 50 kg) ou 150 mg Q2S (si le PC ≥ 50 kg) chez 18 patients pédiatriques (8 à 17 ans) atteints d'HoFH ajouté aux traitements de fond. Les patients ont reçu 75 ou 150 mg d'alirocumab Q2S sans ajustement posologique jusqu'à la 12ème semaine.
Le taux moyen de LDL-C à l'inclusion était de 9,6 mmol/l (373 mg/dl). La variation moyenne en pourcentage du taux de LDL-C entre la référence et la semaine 12 était de -4,1 % (IC à 95 % : -23,1 à 14,9 %) dans la population ITT (N = 18) et était associée à une forte variabilité de la réponse en ce qui concerne la diminution du taux de LDL-C. Le taux de répondeurs atteignant une réduction ≥ 15 % par rapport à la référence, aux semaines 12, 24 et 48 était respectivement de 50 %, 50 % et 39 %.
Traitement de l'hypercholesterolémie familiale hétérozygote (HFHe) chez les patients pédiatriques
L'efficacité et la sécurité de l'alirocumab ont été évaluées chez 153 patients âgés de 8 à 17 ans atteints d'hypercholesterolémie familiale hétérozygote (HFHe) dans le cadre d'une étude de phase 3, multicentrique, randomisée et en double aveugle de 24 semaines. Les patients ont reçu un placebo ou de l'alirocumab. Ce traitement a été suivi d'un traitement en ouvert (OL) de 80 semaines par alirocumab. Les patients devaient suivre un régime pauvre en graisses et recevoir un traitement hypolipémiant de fond. Les patients inclus étaient randomisés par un ratio 2 :1 pour recevoir l'alirocumab selon le schéma Q2S ou Q4S et le placebo.
Dans le schéma posologique Q4S, 79 patients ont reçu une dose de 150 mg pour un poids corporel <50 kg ou une dose de 300 mg pour un poids corporel ≥ 50 kg. L'augmentation de la dose d'alirocumab à 75 mg Q2S pour un poids corporel de < 50 kg ou 150 mg Q2S pour un poids corporel ≥ 50 kg est survenue au cours de la 12ème semaine chez les patients avec un taux de cholesterol LDL ≥ 110 mg/dL.
Période de traitement en double aveugle :
Le critère principal d'évaluation de l'efficacité dans cette étude était la variation en pourcentage du LDL-C entre la valeur de référence et la semaine 24. Les données sont détaillées dans le Tableau 4. Les valeurs absolues moyennes de LDL-C à la semaine 24 étaient de 2,847 mmol/L dans le groupe alirocumab et de 4,177 mmol/L dans le groupe placebo dans la cohorte Q4S. Des réductions du LDL-C ont été observées lors de la première évaluation post-valeur de référence à la semaine 8 et se sont maintenues tout au long des 24 semaines de la période de traitement en double aveugle.
Tableau 4 : Effets du traitement par alirocumab et placebo chez les patients pédiatriques atteints de HFHe
| Variation moyenne en pourcentage par rapport à la valeur de référence à la semaine 24 (%) | ||
| Schéma posologique Q4S | ||
| Placebo | Alirocumab | |
| Nombre de patients | N = 27 | N= 52 |
| LDL-C | -4.4 | -38.2 |
| Non-HDL-C | -3.7 | -35.6 |
| CT | -3.6 | -34.6 |
| Apo B | -3.6 | -34.3 |
LDL-C
= cholesterol à lipoprotéines de basse densité ;
HDL-C = cholesterol à lipoprotéine de haute densité ;
CT = cholesterol total ; ApoB
= apolipoprotéine B. Toutes les valeurs de p ajustées
< 0.0001.
Période de traitement en ouvert
Au total, 74 patients de la cohorte Q4S ont participé à une étude en ouvert à bras unique de 80 semaines. La dose initiale était la dose d'alirocumab sélectionnée pour la période en double aveugle, en fonction du poids corporel et du schéma posologique. La dose pouvait être augmentée ou diminuée par les investigateurs en fonction de leur évaluation médicale. La variation moyenne (VM) en pourcentage du LDL-C par rapport à la valeur référence (au moment de la randomisation durant la période en double aveugle) était de -23,4 % (4,7) à la semaine 104. La variation moyenne (VM) en pourcentage, entre la valeur de référence et la semaine 104, des autres critères d'évaluation lipidiques était : -21,5 % (26,2) de non-HDL-C, -17,8 % (21,7) d'ApoB, - 17,4 % (19,9) de CT.
Absorption
Après l'administration sous-cutanée de 50 mg à 300 mg d'alirocumab, les temps médians écoulés jusqu'à la concentration plasmatique maximale (tmax) étaient de 3 à 7 jours.
La pharmacocinétique de l'alirocumab après une seule administration
sous-cutanée de 75 mg dans l'abdomen, le haut du bras ou la cuisse
était similaire.
La
biodisponibilité absolue de l'alirocumab après une administration
sous-cutanée était d'environ 85 %, comme déterminé par l'analyse de la
pharmacocinétique de population. Une exposition mensuelle à 300 mg
toutes les 4 semaines a été similaire à celle à 150 mg toutes les 2
semaines. Les variations entre la Cmax et la Céq étaient plus importantes avec une administration toutes les 4 semaines.
L'état d'équilibre a été atteint après 2 à 3 doses, avec un rapport d'accumulation d'environ 2 au maximum.
Distribution
Suite à l'administration par voie intraveineuse, le volume de distribution était d'environ 0,04 à 0,05 l/kg, ce qui indique que l'alirocumab est principalement distribué dans le système circulatoire.
Biotransformation
Aucune étude spécifique du métabolisme n'a été menée car l'alirocumab est une protéine. Il est attendu que l'alirocumab se dégrade en petits peptides et en acides aminés individuels.
Élimination
Deux phases d'élimination ont été observées pour l'alirocumab. Aux faibles concentrations, l'élimination s'effectue principalement par liaison saturable à la cible (PCSK9), alors qu'aux concentrations plus élevées, l'élimination de l'alirocumab s'effectue en grande partie par le biais d'une voie protéolytique non saturable.
Selon une analyse de la pharmacocinétique de population, la demi-vie apparente médiane de l'alirocumab à l'état d'équilibre était de 17 à 20 jours chez les patients recevant l'alirocumab en monothérapie à des doses sous-cutanées de 75 mg toutes les 2 semaines ou de 150 mg toutes les 2 semaines. Lorsqu'il était administré avec une statine, la demi-vie apparente médiane de l'alirocumab était de 12 jours.
Linéarité/non-linéarité
Lorsque la dose est doublée, passant de 75 mg à 150 mg toutes les 2 semaines, une augmentation légèrement plus forte que proportionnelle à la dose a été observée, la concentration totale de l'alirocumab étant multipliée par 2,1 à 2,7.
Populations particulières
Personnes âgées
Selon une analyse de la pharmacocinétique de population, l'âge a été associé à une petite différence dans l'exposition à l'alirocumab à l'état d'équilibre, sans impact sur l'efficacité ou la sécurité.
Sexe
Selon une analyse de la pharmacocinétique de population, le sexe n'a pas eu d'impact sur la pharmacocinétique de l'alirocumab.
Origine ethnique
Selon une analyse de la pharmacocinétique de population, l'origine ethnique n'a pas eu d'impact sur la pharmacocinétique de l'alirocumab. Suite à l'administration par voie sous-cutanée d'une dose unique de 100 mg à 300 mg d'alirocumab, il n'y a pas eu de différence significative dans l'exposition entre des sujets sains japonais et les sujets sains caucasiens.
Poids corporel
Dans le modèle final de la pharmacocinétique de population, le poids corporel a été identifié comme une covariable significative ayant un impact sur la pharmacocinétique de l'alirocumab. L'exposition àl'alirocumab (AUC0 à 14j) à l'état d'équilibre dans les deux schémas posologiques de 75 mg et 150 mg toutes les 2 semaines était diminuée de 29 % et de 36 % chez les patients pesant plus de 100 kg comparativement aux patients pesant entre 50 kg et 100 kg. Cela ne s'est pas traduit par une différence cliniquement significative dans la réduction du taux de LDL-C.
Insuffisance hépatique
Dans une étude de phase 1, après l'administration d'une dose unique de 75 mg par voie sous-cutanée, les profils pharmacocinétiques de l'alirocumab chez des sujets présentant une insuffisance hépatique légère à modérée étaient similaires à ceux de sujets dont la fonction hépatique était normale. Aucune donnée n'est disponible pour les patients présentant une insuffisance hépatique sévère.
Insuffisance rénale
Les anticorps monoclonaux n'étant pas connus pour être éliminés par voie rénale, il n'est pas attendu que la fonction rénale ait un impact sur la pharmacocinétique de l'alirocumab. Les analyses de la pharmacocinétique de population ont montré que l'exposition à l'alirocumab (AUC0 à 14j) à l'état d'équilibre dans les deux schémas posologiques de 75 mg et 150 mg toutes les 2 semaines était augmentée de 22 % à 35 % et de 49 % à 50 % chez les patients présentant une insuffisance rénale légère et modérée respectivement, comparativement aux patients dont la fonction rénale était normale. La distribution du poids corporel et de l'âge, deux covariables ayant un impact sur l'exposition à l'alirocumab, était différente selon la catégorie de la fonction rénale ce qui explique très probablement les différences. Peu de données sont disponibles chez les patients présentant une insuffisance rénale sévère ; chez ces patients, l'exposition à l'alirocumab était environ deux fois plus élevée que chez les patients avec fonction rénale normale.
Population pédiatrique
La pharmacocinétique de Praluent a été évaluée chez 140 patients pédiatriques âgés de 8 à 17 ans atteints d'hypercholestérolémie familiale hétérozygote (HFHe). La Cmin moyenne à l'état d'équilibre a été atteinte à la 8ème semaine ou avant (premier prélèvement PK pendant l'administration répétée) avec le schéma posologique recommandé (voir Section Posologie et mode d'administration).
Des données pharmacocinétiques limitées sont disponibles pour 18 patients pédiatriques (8 à 17 ans) atteints d'HoFH. Les concentrations Cmin moyennes d'alirocumab à l'état d'équilibre ont été atteintes à la semaine 12 ou avant, dans les deux groupes d'alirocumab, 75 mg Q2S et 150 mg Q2S. Aucune étude sur l'alirocumab n'a été menée chez les patients pédiatriques de moins de 8 ans (voir la rubrique Propriétés pharmacodynamiques).
Relation(s) pharmacocinétique/pharmacodynamique
L'effet pharmacodynamique de l'alirocumab sur la réduction du taux de LDL-C est indirect et est médié par la liaison à PCSK9. Une réduction dépendante de la concentration du PCSK9 libre et du LDL-C est observée jusqu'à ce que la saturation de la cible soit atteinte. Dès saturation de la liaison à PCSK9, une augmentation supplémentaire de la concentration de l'alirocumab n'entraîne pas de réduction supplémentaire du taux de LDL-C, cependant, on peut observer une prolongation de la durée de l'effet.
Praluent n'a aucun effet ou qu'un effet négligeable sur l'aptitude à conduire des véhicules et à utiliser des machines.
Les données non cliniques n'ont pas révélé de risque particulier chez l'homme sur la base d'études conventionnelles de pharmacologie de sécurité et de toxicologie en administrations répétées.
Les études toxicologiques sur la reproduction chez les rats et les singes indiquent quel'alirocumab, comme les autres anticorps IgG, traverse la barrière placentaire.
Il n'y a pas eu d'effets indésirables sur les marqueurs de la fertilité (par ex. cycles ovariens, volume testiculaire, volume de l'éjaculat, motilité des spermatozoïdes ou numération totale de spermatozoïdes par éjaculat) chez les singes. Aucun changement anatomopathologique ou histopathologique lié à l'alirocumabdans les tissus des organes de la reproduction n'a été constaté dans des études toxicologiques menées chez le rat ou le singe.
Aucun effet indésirable sur la croissance ou le développement fœtal n'a été observé chez les rats ou les singes. Aucune toxicité maternelle n'a été mise en évidence chez les singes femelles à des expositions systémiques 81 fois supérieures à l'exposition humaine à la dose de 150 mg toutes les 2 semaines. Toutefois, on a observé une toxicité maternelle chez les rates gravides à des expositions systémiques estimées être environ 5,3 fois supérieures à l'exposition humaine à la dose de 150 mg toutes les 2 semaines (basée sur l'exposition mesurée chez les rates non gravides au cours d'une étude toxicologique de 5 semaines).
La descendance de singes qui avaient reçu des doses élevées d'alirocumab chaque semaine tout au long de la gestation présentait une réponse immunitaire secondaire plus faible après provocation antigénique que la descendance des animaux témoins. Il n'y a pas eu d'autre signe de dysfonctionnement immunitaire lié à l'alirocumab dans la descendance.
Après utilisation, le stylo pré-rempli/seringue pré-remplie doit être placé dans un collecteur résistant à la perforation. Le récipient ne doit pas être recyclé.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Liste I.
Prescription initiale
annuelle réservée aux spécialités en cardiologie, endocrinologie,
diabète et maladies métaboliques ou de médecine interne.
Prescription initiale élargie aux spécialistes en médecine vasculaire ou en neurologie (Communiqué ANSM du 29/04/2022).
Renouvellement non restreint.
Médicament d'exception.
Prise en charge soumise à l'accord préalable du service médical de
l'Assurance Maladie. En cas d'accord, le formulaire d'accord préalable
tient lieu d'ordonnance de médicament d'exception.
Remboursement en fonction de l'indication (JO du 03/11/2022) :
Les seules indications thérapeutiques ouvrant droit à la prise en charge ou au remboursement par l'assurance maladie sont :
-
Chez les patients adultes présentant une hypercholestérolémie familiale
hétérozygote (HFHe), à très haut risque cardiovasculaire,
insuffisamment contrôlée par un traitement optimisé et nécessitant un
traitement par LDL-aphérèse :
. en association à un traitement hypolipémiant optimisé ;
. ou en monothérapie en cas de contre-indication ou d'intolérance avérée à la fois aux statines et à l'ézétimibe.
-
Chez les patients adultes présentant une maladie cardiovasculaire
athéroscléreuse établie par un antécédent de SCA récent (1) (prévention
secondaire) et qui ne sont pas contrôlés (LDL-c ≥ 0,7 g/L) malgré un
traitement hypolipémiant optimisé :
. en association à un traitement hypolipémiant optimisé ;
. ou en monothérapie en cas de contre-indication ou d'intolérance avérée à la fois aux statines et à l'ézétimibe.
(1) Défini comme ≤ 1 an d'après les critères d'inclusion et non-inclusion de l'étude de morbi-mortalité ODYSSEY OUTCOMES.
Concernant
le sous-groupe de patients ayant une contre-indication ou une
intolérance avérée aux statines et/ou à l'ézétimibe, l'antécédent de
SCA ne doit pas nécessairement être récent compte-tenu du temps
nécessaire à déclarer une myopathie due aux statines.
Solution injectable (injection) en stylo pré-rempli.
Solution limpide, incolore à jaune pâle.
pH :5,7 - 6,3
Osmolarité :
383 - 434mOsm/kg
1 ml de solution injectable dans une seringue (verre siliconé transparent de type 1), munie d'une aiguille sertie en acier inoxydable avec capuchon protecteur d'aiguille (caoutchouc styrène-butadiène) et d'un joint de piston en caoutchouc bromobutyle enduit d'éthylène tétrafluoroéthylene (FluroTec®).
150 mg, solution injectable en stylo pré-rempli :
Les composants de la seringue sont assemblés dans un stylo pré-rempli à usage unique muni d'un capuchon bleu et d'un bouton d'activation gris foncé.
Taille du conditionnement :
2 stylos pré-remplis
Chaque stylo pré-rempli à usage unique contient 150 mg d'alirocumab dans 1 ml de solution.
Alirocumab est un anticorps monoclonal humain de type Immunoglobuline G1 (IgG1) produit dans des cellules ovariennes de hamster chinois par la technique de l'ADN recombinant.
Pour la liste complète des excipients, voir rubrique Liste des excipients.
Histidine
Saccharose
Polysorbate 20
Eau pour préparations injectables
